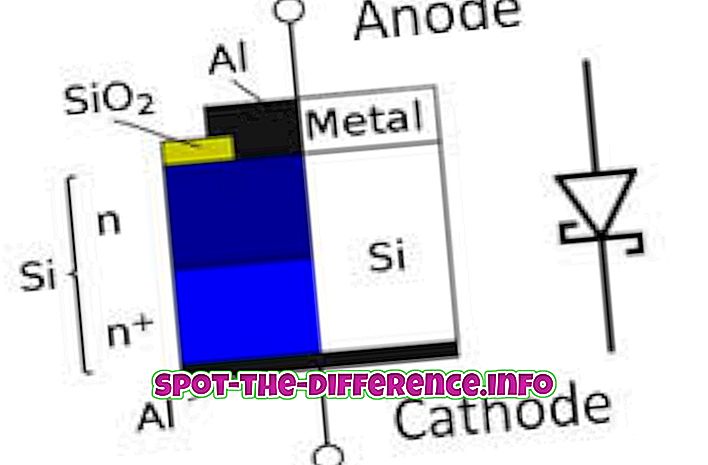
主な違い:イオン結合とは、ある原子が別の原子に電子をあきらめる2つの異なる原子(金属と非金属)の間の化学結合のことです。 共有結合は別の強力な化学結合です。 それは似たような原子(すなわち2つの非金属)が起こった。 共有結合では、2つの原子が一緒になって電子を共有するのではなく、原子が他の原子から電子を取り出すのではありません。

イオン結合は、1つの原子が他の原子に電子をあきらめる2つの異なる(すなわち、金属および非金属)原子間の化学結合である。 したがって、一方の原子には電子が1つ少なく、他方の原子には余分な電子があるため、両方の原子がイオンになります。 電子を失った金属イオンは正電荷を持つ。 電子を得た非金属イオンは負電荷を有する。 反対側が引き寄せられると、これらのイオンは互いに強く引き付けられるので、強く結合します。
イオン性化合物は通常、固体、すなわち塩の形態である。 それらは水に非常に溶けやすく、高い融点を有する。 それらが水中にあるとき、それらはまた高い導電性を有する。

共有結合は、σ結合、π結合、金属間結合、アゴスティック相互作用、および三中心二電子結合を含む多くの種類の相互作用を含む。 原子がその外殻に電子を持ち、別の原子がその外殻を満たすのに電子を必要とする場合、2つの原子が一緒になって電子を共有します。 それゆえ、両方の原子は、完全な外殻およびそれに対応して安定な電子配置を有することになる。
化学結合は、完全な外殻が安定な電子配置を意味するので、原子が完全な外殻を有することができるように作られる。 イオン結合において、金属原子がその外殻に単一の電子を有し、非金属がその外殻を完成させるために電子を必要とする場合、金属原子はその電子を非金属に与える。 同様に、共有結合において、それらは電子を等しく共有する。
イオン結合 | 共有結合 | |
定義 | 原子が別の原子に電子をあきらめる2つの異なる原子間の化学結合。 | 共有結合は、2つの類似した原子間の電子の共有を含む化学結合です。 |
発生 | 金属と非金属 | 2つの非金属 |
極性 | 高い | 低い |
分子の形 | 明確な形状なし、格子構造 | 明確な形 |
電気伝導性 | 高い | 通常はなし |
熱伝導率 | 高い | 通常は低い |
物質の融点 | 変化するが、通常共有結合化合物より高い | 変化するが、通常イオン性化合物より低い |
物質の沸点 | 高い | 変化するが、通常イオン性化合物より低い |
水への溶解度 | 高い | 変化するが、通常イオン性化合物より低い |
室温での物質の状態 | 通常しっかりしている | 固体、液体、ガス |